CEFOTAXIM
NATRI
Cefotaximum natricum
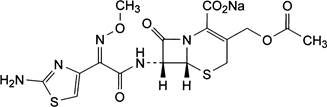
C16H16N5
NaO7S2
P.t.l: 477,4
Cefotaxim
natri là (6R,7R)-3-[(acetyloxy)methyl]-7-[[(Z)-2-(2-aminothiazol-4-yl)-2-(methoxyimino)acetyl]amino]-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-en-2-carboxylat
natri,
phải chứa từ 96,0 đến 101,0% C16H16N5
NaO7S2, tính theo chế phẩm khan.
Tính
chất
Bột
trắng hoặc hơi vàng, hút ẩm, dễ tan trong nước,
hơi tan trong methanol, thực tế không tan trong ether.
Định
tính
Có
thể chọn một trong hai nhóm định tính sau:
Nhóm
I: Phép thử A, D
Nhóm
II: Phép thử B, C, D
A.
Phổ hồng ngoại (Phụ lục 4.2) của chế
phẩm phải phù hợp với phổ hồng ngoại
của cefotaxim natri chuẩn (ĐC).
B.
Tiến hành phương pháp sắc ký lớp mỏng
(Phụ lục 5.4)
Bản
mỏng: Silicagel HF254 (TT) đã silan hóa.
Dung
môi khai triển: Aceton - dung dịch amoni
acetat 15,4% đã
được điều chỉnh trước tới pH
6,2 bằng acid acetic (15
: 85).
Dung
môi pha mẫu (dung dịch A): Hỗn hợp methanol - dung dịch đệm phosphat 0,067 M pH 7,0
(1 : 1).
Dung
dịch thử: Hòa
tan 20 mg chế phẩm trong dung dịch A và pha loãng thành 5,0
ml với cùng dung môi.
Dung
dịch đối chiếu (1): Hòa tan 20 mg cefotaxim
natri chuẩn (ĐC) trong dung dịch A và pha loãng thành 5,0
ml với cùng dung môi..
Dung
dịch đối chiếu (2): Hòa tan 20 mg cefotaxim
natri chuẩn (ĐC) và 20 mg cefoxitin
natri chuẩn (ĐC) trong dung dịch A và pha loãng thành 5,0
ml với cùng dung môi..
Cách
tiến hành:
Chấm riêng biệt lên bản mỏng 1 ml mỗi dung dịch trên.
Triển khai sắc ký đến khi dung môi đi được
15 cm. Lấy bản mỏng ra, để khô và quan sát dưới
ánh sáng tử ngoại ở bước sóng 254 nm. Vết
chính thu được trên sắc ký đồ của dung
dịch thử phải phù hợp về vị trí, kích thước
với vết chính trên sắc ký đồ của dung
dịch đối chiếu (1). Phép thử chỉ có giá
trị khi sắc ký đồ của dung dịch đối
chiếu (2) cho 2 vết tách rõ.
C.
Cho phản ứng B trong phép thử Phản ứng màu
của các penicilin và cephalosporin (Phụ lục 8.3).
D.
Chế phẩm cho phản ứng của natri (Phụ
lục 8.1).
Độ
trong và màu sắc của dung dịch
Dung dịch S: Hòa tan 2,5 g chế phẩm trong nước
không có carbon dioxyd (TT) và pha loãng thành 25,0 ml với cùng dung
môi.
Dung
dịch S phải trong (Phụ lục 9.2). Thêm 1 ml acid
acetic băng (TT) vào 10 ml dung dịch S. Quan sát ngay, dung
dịch thu được phải trong. Độ hấp
thụ (Phụ lục 4.1) của dung dịch S đo ở
bước sóng 430 nm không được quá 0,20.
pH
pH
của dung dịch S từ 4,5 đến 6,5.
Góc
quay cực riêng
Từ
+58o đến +64o, tính theo chế phẩm đã
làm khô (Phụ lục 6.4).
Hòa
tan 0,100 g chế phẩm trong nước và pha loãng thành 10,0
ml với cùng dung môi.
Độ
hấp thụ ánh sáng
Hòa
tan 20,0 mg chế phẩm trong nước và pha loãng thành 100,0
ml với cùng dung môi. Pha loãng 10,0 ml dung dịch thu được
thành 100,0 ml bằng nước. Giá trị A(1%, 1 cm) ở
235 nm phải từ 360 đến 390, tính theo chế
phẩm đã làm khô.
Tạp
chất liên quan
Xác
định bằng phương pháp sắc ký lỏng như
đã mô tả trong mục Định lượng.
Tiêm
dung dịch thử và dung dịch đối chiếu (2). Chạy
sắc ký dung dịch thử trong thời gian ít nhất là 8
lần thời gian lưu của pic chính. Trên sắc ký đồ
thu được của dung dịch thử, bất
kỳ pic nào, trừ pic chính, không được có diện
tích lớn hơn diện tích của pic chính trong dung
dịch đối chiếu (2) (1%); tổng diện tích
của các pic phụ này không lớn hơn 3 lần diện
tích của pic chính trong sắc ký đồ của dung
dịch đối chiếu (2) (3%).
N,N-Dimethylanilin
Không
được quá 20 phần triệu (Phụ lục 10.16,
phương pháp 2).
Acid
2-ethylhexanoic
Không
được quá 0,5% (kl/kl) (Phụ lục 10.17).
Mất
khối lượng do làm khô
Không
được quá 3,0% (Phụ lục 9.6).
(1,000
g, 100 – 105 oC).
Độ vô khuẩn
Nếu
chế phẩm dự định dùng trong sản suất
thuốc tiêm mà không có phương pháp hữu hiệu nào để
tiệt khuẩn thì phải đáp ứng yêu cầu về
phép thử độ vô khuẩn (Phụ lục 13.7).
Nội
độc tố vi khuẩn
Không
được quá 0,05 UI/mg (Phụ lục 13.2), nếu
chế phẩm dự định dùng trong sản suất
thuốc tiêm mà không có phương pháp hữu hiệu nào
loại bỏ nội độc tố vi khuẩn.
Định
lượng
Tiến
hành phương pháp sắc ký lỏng (Phụ lục 5.3)
Pha
động:
Hòa tan 3,5 g kali dihydrophosphat (TT) và 11,6 g dinatri
hydrophosphat (TT) trong 1000 ml nước pH 7,0 và thêm 180 ml methanol
(TT).
Dung dịch
thử: Hòa
tan 25,0 mg chế phẩm trong pha động và pha loãng thành
25,0 ml với cùng dung môi.
Dung
dịch đối chiếu (1): Hòa tan 25,0 mg cefotaxim
natri chuẩn (ĐC) trong pha động và pha loãng thành
25,0 ml với cùng dung môi.
Dung
dịch đối chiếu (2): Pha loãng 1,0 ml dung dịch đối
chiếu (1) thành 100,0 ml bằng pha động.
Dung
dịch phân giải:
Thêm 1,0 ml dung dịch acid hydrocloric loãng (TT) vào
4,0 ml dung dịch thử. Đun nóng dung dịch thu được
ở 40 oC trong 2 giờ. Thêm 5,0 ml dung dịch đệm phosphat
pH 6,6 và 1,0 ml dung dịch natri hydroxyd loãng (TT).
Điều
kiện sắc ký:
Cột
(0,25 m x 4,6 mm) được
nhồi octadecylsilyl silica gel dành cho sắc ký (5 mm).
Detector
quang phổ tử ngoại đặt ở bước
sóng 235 nm.
Tốc
độ dòng: 1,0 ml/phút.
Thể
tích tiêm: 10 ml
Cách
tiến hành:
Tiêm
dung dịch đối chiếu (1) và dung dịch phân giải,
điều chỉnh độ rộng của thang đo
sao cho chiều cao các pic chính của dung dịch phân giải
ít nhất bằng 50% của thang đo. Phép thử chỉ
có giá trị khi cefotaxim được rửa giải như
là pic chính thứ hai và độ phân giải giữa 2 pic
chính ít nhất là 3,5. Nếu cần, dùng pha tĩnh khác
hoặc điều chỉnh nồng độ methanol trong
pha động. Phép thử không có giá trị khi hệ
số đối xứng của pic cefotaxim lớn hơn
2,0. Tiêm dung dịch đối chiếu (1) 6 lần. Phép
thử chỉ có giá trị khi độ lệch chuẩn tương
đối của diện tích pic cefotaxim không lớn hơn
1,0%. Tiếp tục tiêm lần lượt dung dịch
thử và dung dịch đối chiếu (1).
Bảo
quản
Trong
đồ đựng kín và tránh ánh sáng, bảo quản
ở nhiệt độ không quá 30 oC. Nếu
chế phẩm vô khuẩn thì bảo quản trong đồ
đựng kín vô khuẩn.
Nhãn
Chế
phẩm là vô khuẩn thì trên nhãn phải ghi là vô khuẩn.
Chế
phẩm không có nội độc tố vi khuẩn thì trên
nhãn phải ghi là không có nội độc tố vi khuẩn.
Loại
thuốc
Thuốc
kháng khuẩn.
Chế
phẩm
Thuốc
tiêm cefotaxim.